Herausforderung für Medtech-Branche im Doppelpack
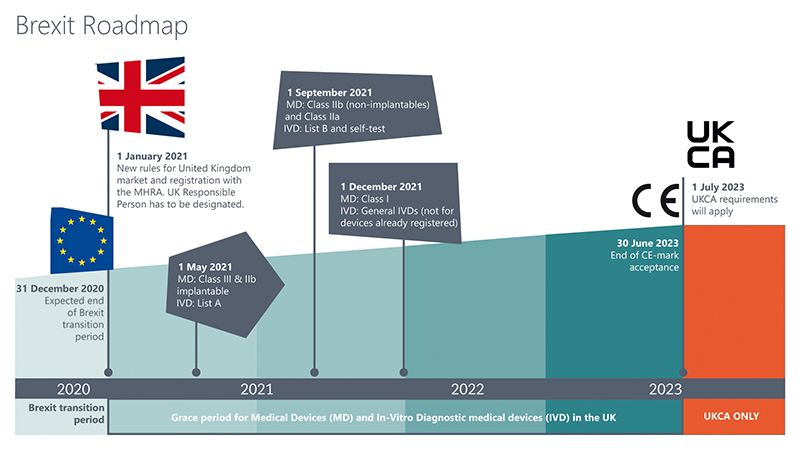
Bereits zum Jahreswechsel entlud der Brexit seine Wucht auf die Akteure in der Medizintechnik: UK, die Union bestehend aus England, Wales, Schottland und Nordirland, geht seitdem einen regulatorischen Sonderweg beim Marktzugang von Medizinprodukten. Rund ein halbes Jahr später trat zudem die MDR mit all ihren Hürden in Kraft. Nun liegen erste gewonnene MDR- und Post-Brexit-Erfahrungen auf dem Tisch. Ein Überblick, garniert mit aktuellen Informationen aus UK.

Die Medizinproduktehersteller haben bereits mit der Einführung der EU-MDR (Medical Device Regulation) am 26. Mai 2021 alle Hände voll zu tun. Die Umstellung der Dokumentation zur Erfüllung der regulatorischen Anforderungen der MDR ist in vollem Gang. Hersteller, die ihre Medizinprodukte außerdem auch auf dem UK-Markt in Verkehr bringen wollen, sind doppelt gefordert, denn technische Dokumentationen müssen dort auf der UK MDR 2002 basieren.
Ein Medizinprodukt – zwei regulatorische Vorschriften
Das bedeutet, dass im Vereinigten Königreich die technische Dokumentation eines Medizinprodukts auf Basis der Richtlinie 93/42/EEC über Medizinprodukte (EU-MDD), der Richtlinie 90/385/EEC über aktive implantierbare medizinische Geräte (EU-AIMDD) oder auf Grundlage der Richtlinie 98/79/EC über In-vitro-Diagnostika (EU-IVDD) erstellt werden muss.
Für die Hersteller von Medizinprodukten bringt das eine Art „doppelte Buchführung“ mit sich: Medizinprodukteakten für den Zielmarkt EU müssen nach den regulatorischen Anforderungen der MDR gepflegt werden, solche für den UK-Markt aber weiterhin nach den Anforderungen der EU-MDD.
Dass UK auch künftig nicht die EU-MDR akzeptieren wird, wurde durch das Inkrafttreten der neuen Gesetzgebung in Form des Medicines and Medical Devices Act 2021 (MMD Act) in UK bekräftigt.
Medical Devices Act 2021 (MMD Act) schafft harte Fakten
Einer der wichtigsten Kernpunkte dieses neuen Gesetzes ist es, dass die Zulassung für neue Gesetze im Medizinprodukte- und Arzneimittelbereich nun beschleunigt stattfinden kann.
Möglich wird das, weil durch dieses Gesetz dem Gesundheitsminister (Secretary of State/ SoS for Health) die Befugnisse verliehen werden, aktuelle regulatorische Rahmenbedingungen zur Regulierung von Medizinprodukten nach seinem Ermessen zu ändern.
Durch den zusätzlich beschleunigten Zulassungsweg im UK-Parlament, in dem solch ein Antrag nicht mehr alle Instanzen des Parlaments durchlaufen muss, kann der Gesundheitsminister so neue Regularien und Gesetzesänderungen zügig auf den Weg bringen, was die Medizinproduktehersteller für das Inverkehrbringen von Medizinprodukten in UK tangieren könnte.
Unserer Einschätzung nach müssen somit künftig die technischen Dokumentationen der Medizinprodukte für den UK-Markt grundlegend überarbeitet werden, da UK seine eigenen regulatorischen Rahmenbedingungen hinsichtlich der Regulierung von Medizinprodukten erlassen wird, die sich nach Aussage der UK-Regierung grundlegend von der EU-MDR unterscheiden werden.
Wie schnell ist ein UK-Marktzugang möglich? It depends ...
Während es 58 Benannte Stellen nach MDD in ganz Europa gab, sind bislang lediglich 23 europäische Benannte Stel-len für die Medical Device Regulation EU 2017/745 akkreditiert (Stand: Ende September 2021) – und bei diesen Benannten Stellen für den Zugang nach MDR kommt es bereits zu langen Wartezeiten für die Ausstellung von MDR-Zertifikaten.
Im Vergleich hierzu sind bisher nur drei UK-Benannte Stellen in UK anerkannt, die Kapazität der Benannten Stellen für die Zulassung von Medizinprodukten in UK ist damit auf etwa fünf Prozent der vorher vorhandenen Benannten Stellen gesunken. In beiden Fällen ist für den Hersteller eine gute strategische Planung unerlässlich, um unnötige Wartezeiten für die Zulassung seiner Medizinprodukte auf dem Zielmarkt EU und dem Zielmarkt UK zu vermeiden.
Neue Rollen zur Einhaltung der Regulierungsvorschriften
Im Zuge der Einführung der MDR betritt ein brandneuer Player die große Bühne: die PRRC, „Person Responsible for Regulatory Compliance“. Diese Person ist zuständig für die Einhaltung von Regulierungsvorschriften und muss vom Hersteller benannt und im Unternehmen installiert werden. Auch in UK ist solch eine Person mit ähnlicher Funktion unerlässlich. Die Regierung des Vereinigten Königreichs verpflichtet Hersteller, eine geeignete „UK-Responsible Person“ (UKRP) zu benennen.
Während die PRRC aber in der EU und somit im eigenen Unternehmen ansässig sein kann, fordert das Vereinigte Königreich, dass die UKRP in UK ansässig sein muss, also in England, Wales, Schottland oder Nordirland. Das stellt insbesondere die Medizinproduktehersteller vor eine Herausforderung, die keine Niederlassung in einem dieser Länder haben.
Hier muss eine in UK ansässige, geeignete natürliche Person gefunden werden. Doch der Pool mit Anbietern, die diese Aufgabe als rechtliche Vertreter innerhalb des UK übernehmen, ist nicht unendlich groß.
Und gerade deshalb gilt es, auch hier genau hinzuschauen, um einen geeigneten und qualifizierten rechtlichen Vertreter als UKRP auszuwählen. Hersteller sollten sich gewissenhaft mit den vertraglichen Regelungen auseinandersetzen, um einerseits alle regulatorischen Anforderungen zu erfüllen und andererseits ein solides Rahmenwerk für eine partnerschaftliche Zusammenarbeit mit solch einem Dienstleister zu gewährleisten.
Zusammenfassend bedeutet dies für einige Hersteller, dass sie nicht nur die Rolle der PRRC neu installieren müssen und gegebenenfalls hierfür zusätzliche Ressourcen benötigen, sondern dass auch eine weitere Person als rechtlicher Vertreter auf dem UK-Markt beauftragt werden muss.
Inverkehrbringen in der EU und UK – eine Frage der Wirtschaftlichkeit
Für einige Hersteller stellt sich natürlich außerdem die Frage nach der Wirtschaftlichkeit, weil neben der Erfüllung der Anforderungen der EU-MDR gleichzeitig auch noch Strukturen für den Marktzugang in UK geschaffen werden müssen.
Neben der Beauftragung einer UKRP für den UK-Markt, der Installation der Rolle der PRRC nach den Anforderungen der MDR und der Aufrechterhaltung einer zweiten technischen Dokumentation nach UK-Regularien parallel zu MDR und IVDR müssen Hersteller weiteren Anforderungen mit Blick auf bestehende Unternehmensprozesse gerecht werden:
- der Umstellung der Produktkennzeichnung von UK-Produkten, der Implementierung der Konformitätsbewertungsverfahren nach UK-Regularien sowie
- der Kommunikation mit der UK-Benannten Stelle zusätzlich zur Kommunikation mit der EU-Benannten Stelle für die Zulassung von Medizinprodukten.
Die Erfüllung der regulatorischen Anforderungen beider Zielmärkte ist auch eine Ressourcenfrage:
- Welcher Mehrbedarf entsteht und wie soll dieser gedeckt werden?
- Wie viele neue Mitarbeiterinnen und Mitarbeiter müssen unter Umständen eingestellt werden?
- Welches Know-how müssen sie mitbringen?
Des Weiteren müssen eventuell Prozesse innerhalb des Unternehmens angepasst, Lieferketten optimiert und durch die neue UK-Kennzeichnung auch das Verpackungsdesign von Medizinprodukten für den UK-Markt angepasst werden.
Und das, bevor überhaupt klar ist, welche Regularien zukünftig auf dem UK-Markt gelten werden und wie sich Verpackung, Kennzeichnung und Begleitinformationen (wie Gebrauchsanweisungen) für die Erfüllung der künftig geltenden UK-Regularien verändern werden, was eine erneute Anpassung von Prozessen, technischen Dokumentationen, Verpackungen und anderen Dokumenten wahrscheinlich macht.
Ähnlich wie bei Einführung der MDR zeichnet sich hier ein Trend ab: Einige Hersteller überarbeiten ihr Produktportfolio und wollen nicht mehr alle Produkte nach UK liefern. Auf jeden Fall sollten sich alle betroffene Medizinproduktehersteller dieser Herausforderung zügig stellen und ihr Produktportfolio entsprechend anpassen und Produkte benennen, die für die Bereitstellung auf dem UK-Markt wirtschaftlich nicht (mehr) rentabel sind.